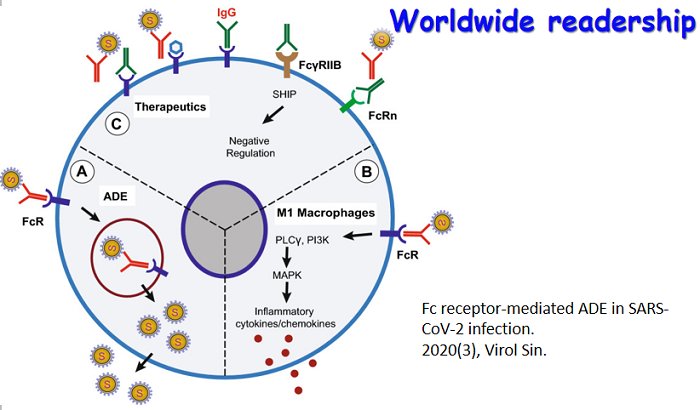
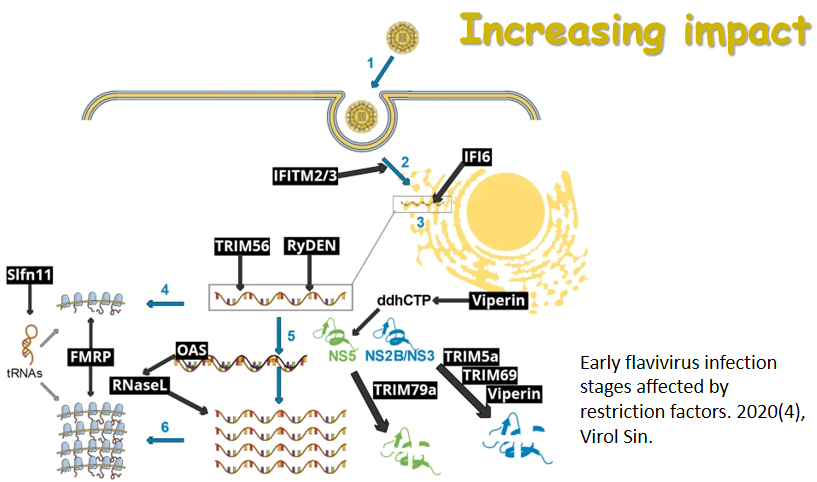
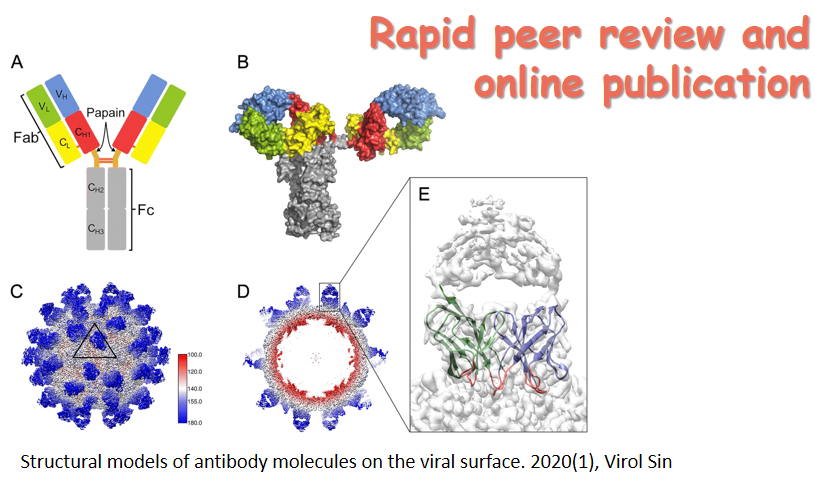
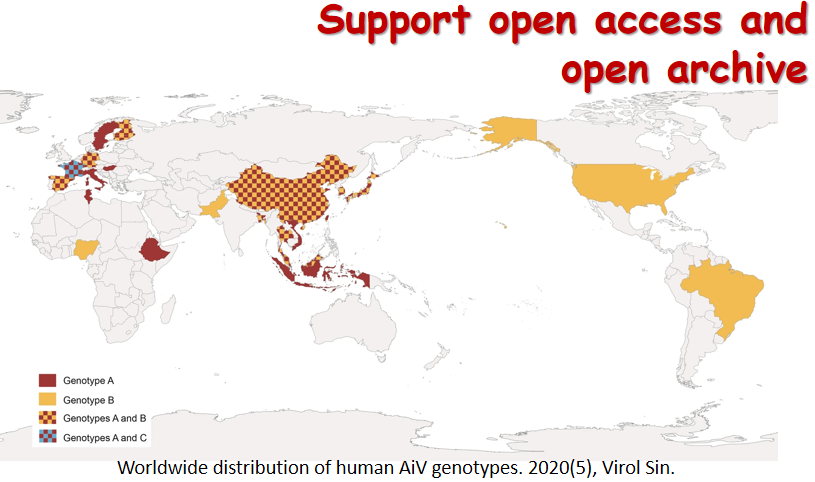
近日,复旦大学陆路和姜世勃团队于AIDS 杂志发表题为“Revisiting the mechanism of enfuvirtide and designing an analog with improved fusion inhibitory activity by targeting triple sites in gp41” 的研究论文。该研究对于抗HIV多肽药物恩夫韦肽(enfuvirtide, T20)作用机制的学术争论提供了新的观点和证据。

1993年,在美国纽约血液中心工作的姜世勃博士报道了第一个衍生于HIV-1 gp41 CHR区的抗HIV多肽SJ-2176(aa 630-659)(图1)(Jiang et al, Nature 1993; BBRC 1993)。其专利于1997年转让给美国Trimeris制药公司,该公司与罗氏制药公司合作,研发出世界上第一个被美国FDA批准上市的基于HIV进入抑制剂的多肽药物⸻恩夫韦肽(T20)。但近二十年来,对于T20 (aa 638-673) (图1)的作用机制一直争论不休。
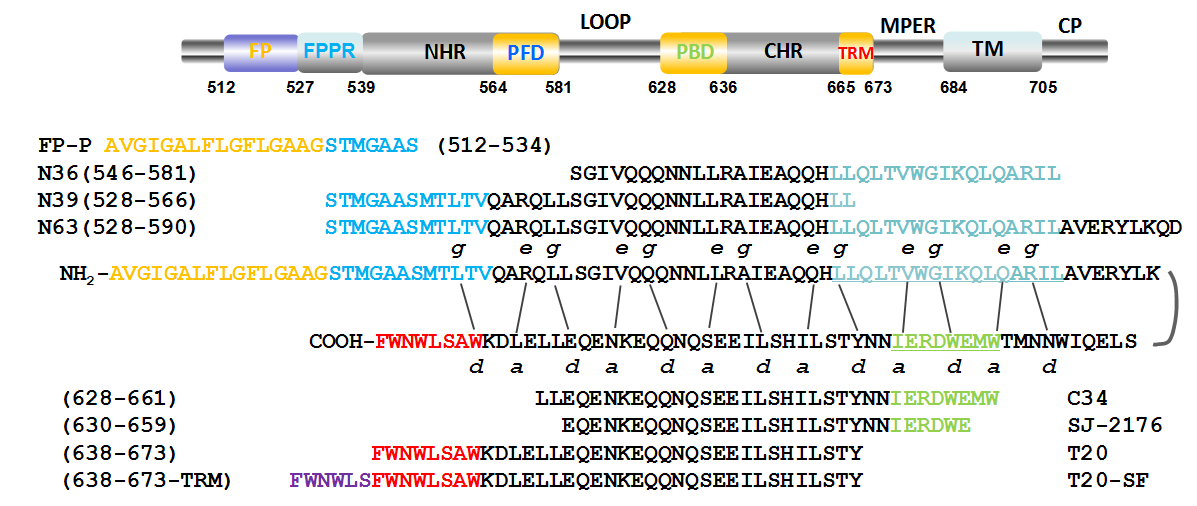 >
>
图1. HIV-1 gp41及其衍生多肽示意图(FP、FPPR、PFD、PBD和TRM的序列分别以黄色、深蓝色、浅蓝色、绿色和红色突出显示)
1997年,美国麻省理工学院(MIT)的研究人员发现衍生于gp41 CHR和NHR的多肽⸻C34(aa 628-661)和N36(aa 546-581)(图1)能够相互作用形成稳定的coiled-coid螺旋六聚体(6HB),因此认为C34和SJ-2176都能与病毒的NHR作用形成异源6HB而阻断病毒的CHR与NHR作用形成同源6HB,从而抑制了病毒与宿主细胞的融合(Chan et al, Cell 1997)。此后,许多科学家认为与C34有70%相同氨基酸序列的T20应该具有与C34相同的作用机制。但2005年,在纽约血液中心学习和工作的刘叔文博士(现为南方医科大学教授)的研究证明,因为T20不含有C34所具有的口袋结合区(PBD)(图1),因此T20与N36的结合是不牢固的,不能在体外实验中检测到T20与N36形成的6HB,T20也不能阻断C34与N36结合形成6HB,因此推断其作用机制可能与C34不同。他们还发现T20含有C34所不具有的色氨酸富集区(TRM)(图1),因此认为虽然T20 N端与NHR发生不牢固的结合,但可能通过其C端的TRM与靶细胞膜结合来促进其与NHR的结合而发挥其抗病毒作用(Liu et al, JBC 2005)。后来在纽约血液中心工作的何玉先博士(现为中国医学科学院暨北京协和医学院艾滋病研究中心教授)证明C34 PBD中的D632可与N36 PFD中的K574相互作用形成盐桥,促进6HB的形成,但T20不含PBD,所以不能有效地与HIV-1 NHR区的PFD结合形成6HB(He et al, JBC 2007;J Virol 2008)。最近,何玉先团队发现T20可以与N39多肽(aa 528-566)【含有gp41的融合肽近端区(FPPR)的序列和NHR区N端的部分序列,但不含有NHR C端的口袋形成区(PFD)序列】(图1)可形成6HB,并解析出其晶体结构。因此认为T20可以与HIV-1 gp41的FPPR序列和NHR区的N端部分序列结合形成异源6HB而抑制病毒与靶细胞的融合(Zhang et al, AIDS 2019)。
几乎同时,复旦大学陆路和姜世勃的团队也发现T20与包含有融合肽(FP)及FPPR的FP-P多肽结合,并抑制FP-P介导的溶血作用,提示T20可能通过与病毒gp41的NHR N端部分序列及FPPR或FP结合而抑制HIV-1与宿主细胞的融合。他们使用温度控制的细胞-细胞融合模型证明T20只能在膜融合的早期,而不是晚期,抑制病毒感染细胞表面天然6HB的形成,提示T20除了与NHR结合,还可能与NHR之外的其它位点(如FPPR或FP)作用来发挥其抗HIV-1的功能。
为了进一步地证实该假说,复旦大学研究团队在T20的C端又连接了一段TRM序列(图1),获得了一条新的多肽⸻T20-SF。结果显示,T20-SF与FP-P有更好的结合能力,能更有效地抑制FP-P介导的溶血活性,其抗HIV-1的活性也比T20提高了20多倍。表明T20-SF可能同时作用于HIV-1 gp41上的三个位点,即NHR、FPPR、FP, 能在病毒与细胞膜融合的初始阶段(在FP暴露之后,扎入细胞膜之前)发挥抗病毒作用。因此,该研究揭示了T20的作用机制的新细节(图2),使该机制更加清晰,对于最终结束争论具有重要的意义。并且根据该新揭示的机制细节成功设计了一条具有更高抗病毒活性的多肽⸻T20-SF,有潜力开发成为新型的抗HIV-1多肽药物。
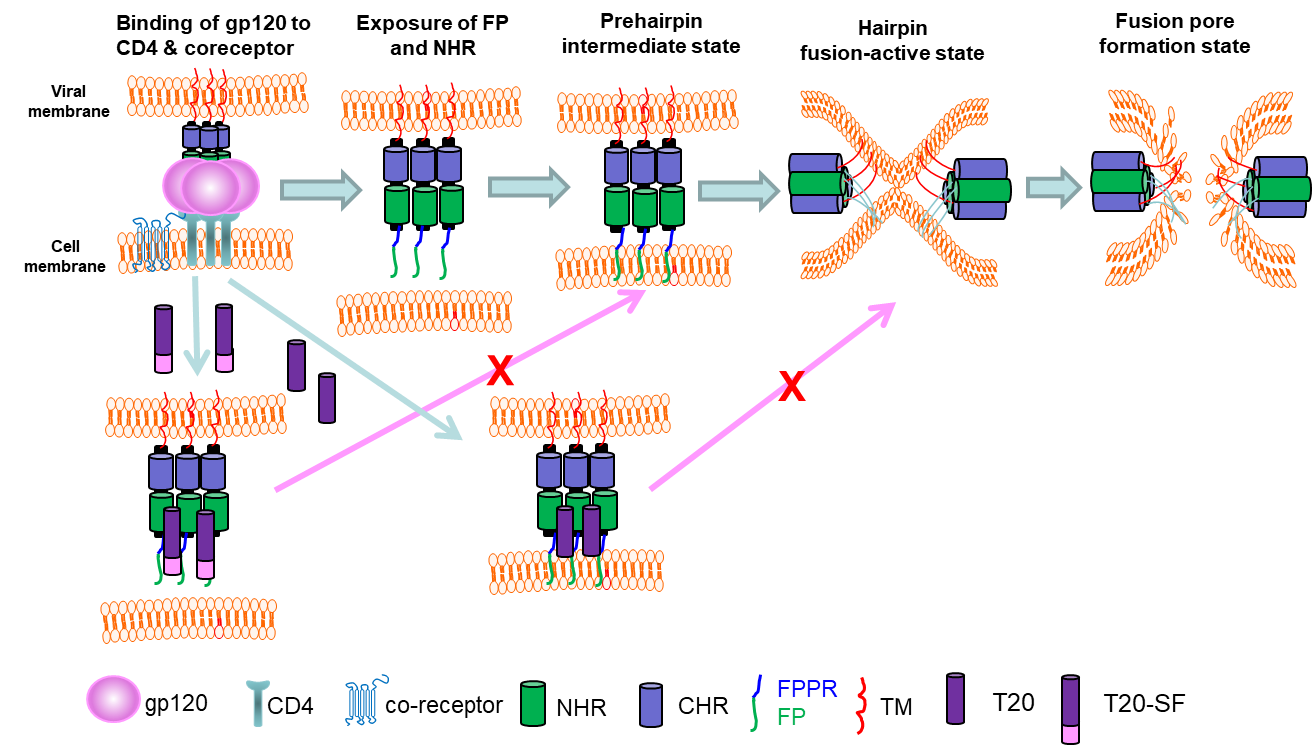
图2. T20作用机制的示意图
复旦大学基础医学院医学分子病毒学教育部/卫健委重点实验室博士后徐巍,博士生蒲静、苏珊为该论文的共同第一作者,陆路、姜世勃和王茜为共通讯作者。该研究得到了国家自然科学基金和上海启明星计划的支持。
参考文献:
Jiang S, Lin K, Strick N, Neurath AR. HIV-1 inhibition by a peptide. Nature 1993; 365:113.
Jiang S, Lin K, Strick N, Neurath AR. Inhibition of HIV-1 infection by a fusion domain binding peptide from the HIV-1 envelope glycoprotein gp41. Biochem Biophys Res Commun 1993; 195:533-538.
Chan DC, Fass D, Berger JM, Kim PS. Core structure of gp41 from the HIV envelope glycoprotein. Cell 1997; 89:263-273.
Liu S, Lu H, Niu J, Xu Y, Wu S, Jiang S. Different from the HIV fusion inhibitor C34, the anti-HIV drug Fuzeon (T-20) inhibits HIV-1 entry by targeting multiple sites in gp41 and gp120. J Biol Chem 2005; 280:11259-11273.
He Y, Liu S, Jing W, Lu H, Cai D, Chin DJ, Debnath AK, Kirchhoff F, Jiang S. Conserved residue Lys574 in the cavity of HIV-1 Gp41 coiled-coil domain is critical for six-helix bundle stability and virus entry. J Biol Chem 2007; 282:25631-25639.
He Y, Liu S, Li J, Lu H, Qi Z, Liu Z, Debnath AK, Jiang S. Conserved salt bridge between the N- and C-terminal heptad repeat regions of the human immunodeficiency virus type 1 gp41 core structure is critical for virus entry and inhibition. J Virol. 2008; 82:11129-11139.
Zhang X, Ding X, Zhu Y, Chong H, Cui S, He J, et al. Structural and functional characterization of HIV-1 cell fusion inhibitor T20. AIDS 2019; 33:1-11.