宿主长链非编码RNA(lncRNAs)被认为是揭示病毒与宿主相互作用潜在机制的新突破点。已报道甲型流感病毒(IAV)感染可引起大量lncRNAs的差异表达,而得到深入研究的lncRNAs多为通过调节宿主免疫应答反应来参与宿主抗病毒天然免疫和病毒的逃逸,但lncRNAs在IAV复制过程中的生物学功能,尤其对病毒如何利用干扰素非依赖的宿主lncRNAs来促进自身复制的分子机制仍知之甚少。
6月11日,医科院医药生物技术研究所岑山教授课题组在Cell Reports杂志发表了题为Influenza virus exploits an interferon-independent lncRNA to preserve viral RNA synthesis through stabilizing viral RNA polymerase PB1的研究论文,发现了干扰素非依赖的宿主长链非编码RNA IPAN调控流感病毒复制的新机制。

在这项工作中,研究人员首先利用IAV诱导型报告基因检测系统,对靶向人类已知lncRNAs的esiRNA库进行了高通量筛选,获得50个参与IAV复制的候选lncRNAs,并发现一种干扰素非依赖的lncRNA—IPAN能够被IAV劫持并促进IAV复制。IPAN的沉默和过表达实验证明了IPAN特异性正向调控IAV的复制(图1)。在IAV复制子系统中,IPAN沉默可以显著下调病毒RNA水平,但对IAV感染早期的RNP复合物入核没有影响,这表明IPAN通过作为IAV聚合酶 RdRp复合物的重要辅助因子来参与调控病毒RNA的转录复制过程。
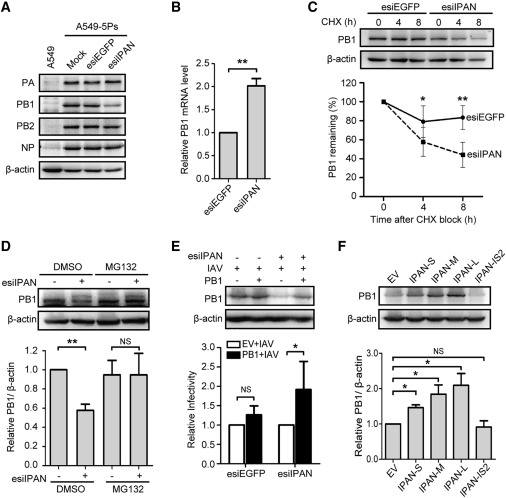
图1 IPAN沉默显著下调病毒RNA水平。
同时,研究人员发现IAV感染能够特异性上调细胞内IPAN水平,但IPAN的表达并不受干扰素α和poly(I:C)处理的影响。RNA-FISH结果显示IAV感染可促进IPAN的核转运,这些结果证明IAV感染不仅促进了IPAN的表达,而且也能将IPAN募集入核以利于病毒自身复制。
进一步的分子机制研究表明,IPAN沉默显著促进病毒PB1蛋白的降解。在此基础上过表达PB1蛋白,病毒复制能力也显著回升,这表明IPAN通过维持PB1蛋白的稳定性来促进IAV的复制(图2)。同时,研究人员利用RNA免疫沉淀技术证明IPAN能够与PB1特异结合。进一步利用RNA pulldown技术在IAV感染的细胞中验证IPAN与PB1的相互作用。上述结果提示IAV通过劫持IPAN,结合PB1进而稳定PB1。
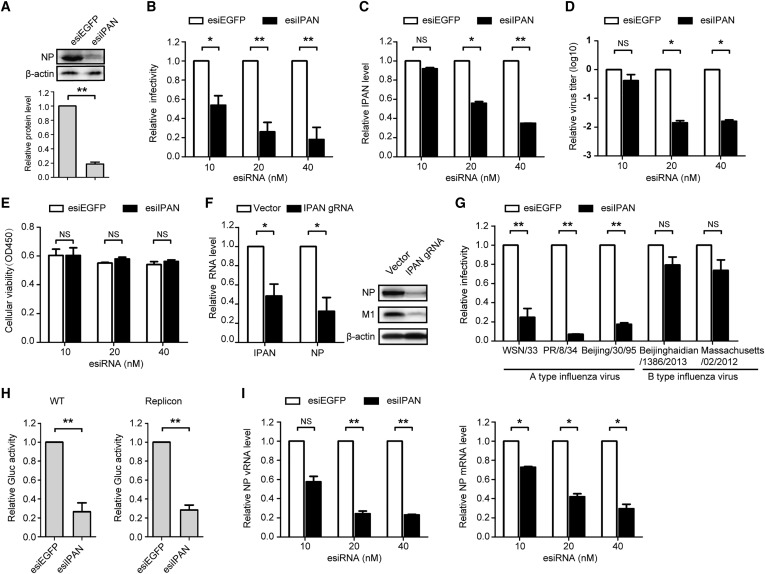
图2 IPAN通过维持PB1蛋白的稳定性来促进IAV的复制。
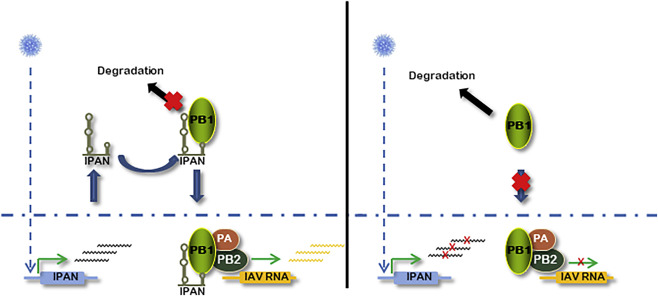
总之,该研究发现了一种干扰素非依赖的lncRNA IPAN,能够被IAV感染特异性诱导表达,通过结合并稳定病毒PB1蛋白来保证病毒RNA的高效合成。该研究首次揭示了宿主lncRNAs通过调控病毒蛋白稳定性而在促进病毒复制过程中发挥重要功能,为深入阐明lncRNAs在病毒-宿主相互作用中的生物学功能提供了新的思路。
医科院医药生物技术研究所岑山研究员和李晓宇副研究员为该论文的共同通讯作者,岑山教授课题组的助理研究员王静博士和张永欣博士为该论文的共同第一作者。该项工作得到了十三五传染病重大专项(2018ZX10301408)、国家重点研发专项(2016YFD0500307)、国家自然科学基金委(81501756)、北京市新发传染病重点实验室开放课题和中国医学科学院卫生与健康创新工程(2017-I2M-1-012、2018-I2M-3-004)的项目资助。