3月4日,微生物领域权威杂志Nature Microbiology 报道了清华大学药学院谭旭课题组、复旦大学周峰课题组和美国乔治梅森大学吴云涛课题组结合高灵敏度深度覆盖蛋白质谱技术和病毒学研究,发现了人类细胞中的一种新型抗艾滋病毒蛋白PSGL-1(P-selectin glycoprotein ligand 1)。PSGL-1具有多重抗病毒功能,包括抑制病毒DNA复制和新生病毒颗粒的新一轮感染。艾滋病毒通过其附属蛋白Vpu结合PSGL-1蛋白并促进PSGL-1的降解,从而逃逸PSGL-1的抗病毒功能。研究Vpu和PSGL-1的结合抑制剂有可能为研发新型抗艾滋病药物带来希望。原文题为“Proteomic profiling of HIV-1 infection of human CD4+ T cells identifies PSGL-1 as an HIV restriction factor”。

由于艾滋病毒感染细胞时,能够挟持细胞中一些重要的蛋白质降解通路,大范围的影响宿主细胞中蛋白质的稳定性。因此,仅仅通过二代测序得到转录组变化很难全面反映艾滋病病毒在感染过程中与宿主细胞间的相互抑制关系。谭旭/周峰/吴云涛团队通过运用高灵敏度的蛋白质质谱技术(sensitive isobaric tag-based quantitative mass spectrometry technology)比较原代CD4 T细胞感染艾滋病毒前后的细胞蛋白水平,在总共鉴定出的~14,000种蛋白中,找到了近千个有显著变化的蛋白。然后通过与其它多个数据库--特别是与人类高度进化的基因清单比对,筛选出一个在艾滋病毒病毒侵染中功能未知的蛋白—PSGL-1(P-selectin glycoprotein ligand 1)。之前的研究表明PSGL-1存在于白细胞膜上,且能够调控白细胞的运动。当身体发生炎症反应时,PSGL-1能够使减缓白细胞的运动速度,最终黏附在炎症反应部位,从而保持机体的稳态【7】。2016年发表的一项研究表明PSGL-1可以调节免疫反应【8】。
在这项最新的研究中,研究者发现高水平的PSGL-1能够抑制病毒感染前期的DNA合成。更重要的是,在新生成的病毒释放时,PSGL-1能被一并包裹到释放的病毒中,从而更强烈地抑制新一轮的病毒感染(示意图)。进一步,研究人员验证了细胞在感染病毒后PSGL-1蛋白水平大幅下降。接着他们发现艾滋病毒附属蛋白Vpu通过招募体内的泛素连接酶复合物并特异性地结合和降解PSGL-1。
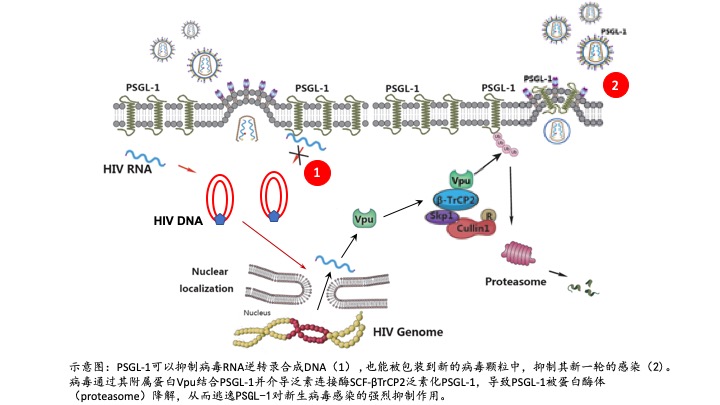
综上所述,该研究通过高灵敏度蛋白质组学首次发现并证实了PSGL-1是一个具有全新抗病毒机制的抗艾滋病毒蛋白,证实了艾滋病毒确实能够通过Vpu招募泛素酶复合物来降解PSGL-1以逃逸人体的天然免疫系统。抑制Vpu对PSGL-1的拮抗有望成为抗艾滋病毒药物开发的新方向。
该论文第一作者为清华大学药学院博士生刘映,乔治梅森大学访问学者傅雅静为共同第一作者。谭旭,周峰,吴云涛为共同通讯作者。
参考文献:
1. Malim M H , Bieniasz P D . HIV Restriction Factors and Mechanisms of Evasion[J]. Cold Spring Harbor Perspectives in Medicine, 2012, 2(5):a006940-a006940.
2. Mariani R , Chen D , Schr?Felbauer B , et al. Species-Specific Exclusion of APOBEC3G from HIV-1 Virions by Vif[J]. Cell, 2003, 114(1):0-31.
3. Perez-Caballero D , Zang T , Ebrahimi A , et al. Tetherin Inhibits HIV-1 Release by Directly Tethering Virions to Cells[J]. Cell, 2009, 139(3):0-511.
4. Neil S J D , Zang T , Bieniasz P D . Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu[J]. NATURE, 2008, 451(7177):425-430.
5. Lu J , Pan Q , Rong L , et al. The IFITM proteins inhibit HIV-1 infection[J]. Journal of Virology, 2011, 85(5):2126-2137.
6. Usami Y , Wu Y , Heinrich G Göttlinger. SERINC3 and SERINC5 restrict HIV-1 infectivity and are counteracted by Nef[J]. Nature, 2015, 526(7572):218-223.
7. Katayama Y , Hidalgo A , Furie B C , et al. PSGL-1 participates in E-selectin-mediated progenitor homing to bone marrow: evidence for cooperation between E-selectin ligands and alpha4 integrin[J]. Blood, 2003, 102(6):2060.
8. Tinoco R , Carrette F , Barraza M , et al. PSGL-1 Is an Immune Checkpoint Regulator that Promotes T Cell Exhaustion[J]. Immunity, 2016, 44(5):1190-1203.
扩展阅读:
VS好文推荐系列 | 艾滋病毒专题