近日,上海科技大学仓勇教授团队在国际权威杂志Science Advances上发表题为“Restriction of hepatitis B virus replication by c-Abl-induced proteasomal degradation of the viral polymerase”的研究成果。这一研究对于在临床中发现的由靶向药物诱导的乙肝病毒再激活的现象提供了机制解释,揭示了c-Abl非受体型酪氨酸激酶通过促进CRL4Cdt2 E3泛素连接酶泛素化降解HBV聚合酶,进而降低HBV复制。

根据世界卫生组织2017年最新报告显示,全球范围内大约有2.57亿乙型肝炎病毒慢性感染的病人,这些病人的病程会进一步恶化,发展为诸如肝硬化、肝癌等重大疾病。如果这些慢性乙肝病毒感染的病人患有其他疾病比如慢性髓系白血病或多发性骨髓瘤,他们接受分子靶向药物如伊马替尼(Imatinib,Abl 激酶抑制剂)或硼替佐米(Bortezomib, 蛋白酶体抑制剂)进行治疗时, 经常会伴随乙肝病毒的再激活,然而这中间的机制并不清楚。c-Abl是一种Abl家族的非受体型酪氨酸激酶,它参与多种细胞反应过程如调节细胞生长和存活、细胞应激反应和细胞骨架动力学。c-Abl的激酶活性被活化后,能够磷酸化受损的DNA结合蛋白1 (DDB1),促进cullin-RING ligase 4 (CRL4)复合物(CUL4-DDB1-Roc1/2)对其底物进行泛素化,随后引发一系列反应来调控DNA修复和染色质重构、细胞周期进程和肿瘤发生等。
仓勇团队发现,在细胞水平上增强c-Abl的激酶活性可以促进HBV聚合酶(Pol)泛素化降解从而下调Pol蛋白水平。该团队2017年发表在Journal of Biological Chemistry的研究发现c-Abl激酶可以通过磷酸化CRL4 E3泛素连接酶的底物接头蛋白DDB1,促进招募小分子调控蛋白DDA1,促进CRL4的活性。团队进一步研究发现CRL4通过底物接头蛋白Cdt2结合HBV-Pol蛋白进行泛素化降解,而这一过程是被c-Abl激酶所激活的。研究结果还进一步显示,由于Pol在HBV复制中起到重要作用,所以在c-Abl激酶调控Pol蛋白水平的同时也会下调HBV的复制水平(图1)。
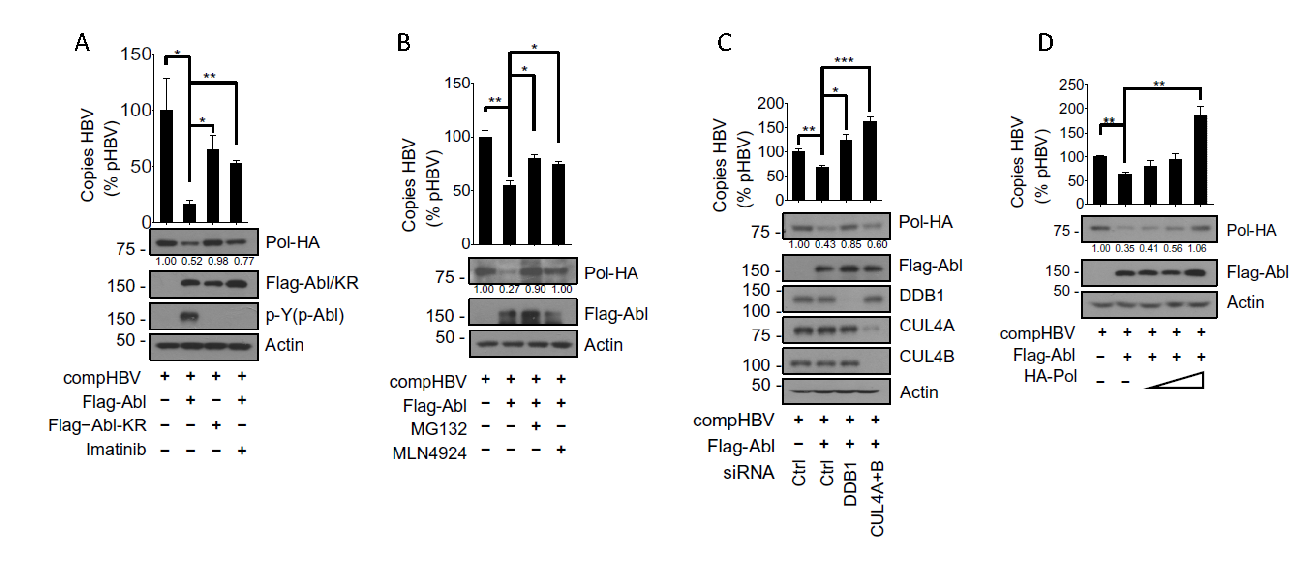
图1.c-Abl激酶通过CRL4泛素连接酶下调HBV聚合酶,增强病毒复制
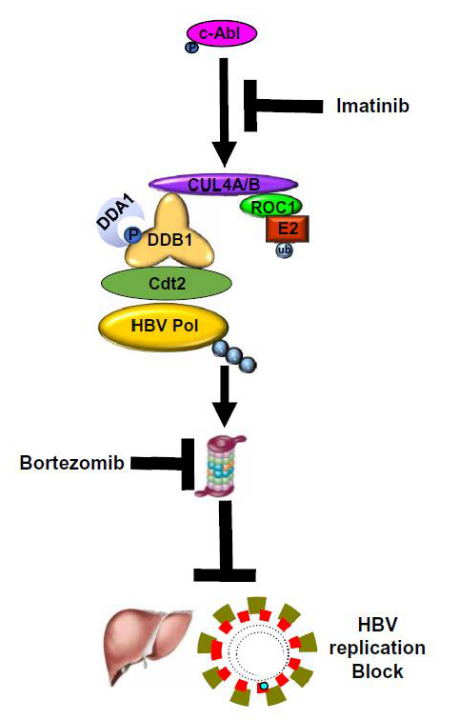
图2. c-Abl激酶调控HBV复制的示意图
这项研究提醒HBV携带者在使用靶向药物如伊马替尼或硼替佐米时需要同时服用抑制HBV复制的药物,注意随时监测乙肝病毒的激活。除此以外,这项研究也提出了c-Abl-CRL4作为潜在控制HBV复制的治疗途径。
浙江大学生命科学研究院侯丽丹博士和浙江大学医学院附属邵逸夫医院赵杰博士为文章的共同第一作者,仓勇教授为通讯作者。这项研究得到了国家重点基础研究发展计划(973计划)(2015CB553803),国家自然科学基金(91429302)和国家'985'重点建设项目的资助。
文章链接:
http://advances.sciencemag.org/content/5/2/eaau7130
扩展阅读: