2019年2月27日,来自军事科学院军事医学研究院秦成峰团队、中科院武汉病毒所周溪团队与中科院动物所胡宝洋团队的科研人员协同攻关,在抗病毒免疫研究领域取得重要进展,发现人神经前体细胞可以利用RNAi抗病毒机制抵抗寨卡病毒感染,首次揭示了RNAi这一古老的抗病毒机制在人类发育过程中的关键作用。该研究于以Zika virus infection induces RNAi-mediated antiviral immunity in human neural progenitors and brain organoids为题发表于Cell Research上。

2016年以来,寨卡病毒疫情在南美大规模暴发,并迅速席卷全球,导致大量新生儿小头畸形病例的出现,被世界卫生组织宣布为“国际关注的突发公共卫生事件”。寨卡病毒是一种古老的虫媒黄病毒,主要通过媒介蚊虫叮咬传播,其流行范围也一直局限在非洲和亚洲少数国家。秦成峰团队一直从事虫媒黄病毒致病机制研究,利用孕鼠动物模型发现,寨卡病毒感染可直接突破血胎屏障,特异靶向和感染胎脑神经前体细胞引起分化异常,进而致使未成熟神经元的大量死亡,从而导致小头畸形的出现【1,2】。更为重要的是,寨卡病毒在其从亚洲向美洲扩散过程中,其关键蛋白出现重要适应性突变,显著增加其对人类神经前体细胞(Neural progenitor cells, NPCs)的嗜性,从而导致更为严重的小头畸形【3,4】。然而,人类神经前体细胞中如何抵御寨卡病毒目前尚不清楚。
RNA干扰(RNAi)是一种在真核生物中高度保守的转录后基因沉默机制,此前的观点认为,RNAi主要在真菌、植物和昆虫等无脊椎动物中发挥抗病毒免疫作用。当病毒感染宿主细胞后,病毒基因组RNA复制所产生的双链RNA被宿主RNAi通路关键蛋白Dicer识别并切割成病毒来源的小干扰RNA(siRNA),这些siRNAs能够进一步通过下游的RISC介导同源病毒基因组RNA的降解,从而达到清除病毒的目的。
哺乳动物由于具有以干扰素反应为代表的抗病毒防御体系,RNAi的抗病毒免疫一直未被发现。2013年,美国美国加州大学河边分校丁守伟等人首次利用一种昆虫Nodamura病毒发现,哺乳动物细胞同样具备RNAi抗病毒通路,敲除Nodamura病毒的B2蛋白后可在宿主细胞中检测到大量病毒来源的siRNA【5】。此后,中科院武汉病毒所周溪等首次证实人类肠道病毒EV71非结构蛋白3A可抑制RNAi通路,只有当3A的VSR活性被突变后,EV71才能在哺乳动物细胞激发RNAi免疫反应【6】。然而,由于在正常病毒感染的哺乳动物细胞中始终未能检测到病毒来源的siRNA,RNAi能否作为哺乳动物抗病毒免疫机制始终存在争议。
在本项研究中,研究团队从寨卡病毒对人类神经前体细胞独特的感染嗜性入手,首次在病毒自然感染的条件下,检测到大量病毒来源的siRNA,证明了人类病毒感染的确能够有效的激发RNAi抗病毒机制(图1);此外,通过对RNAi通路关键信号分子进行缺失或抑制,均能显著的促进病毒在神经前体细胞中的复制。更为重要的是,研究人员发现对于发育成熟的神经元和体细胞,寨卡病毒感染并不能激发RNAi免疫,这也暗示RNAi抗病毒免疫在神经发育过程中可能是逐渐衰退的。
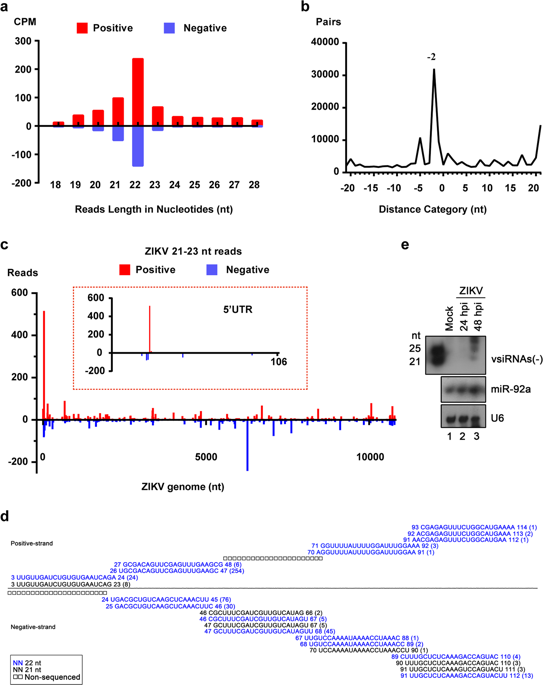
图1 在病毒自然感染的神经前体细胞中检测到大量病毒来源的siRNA,证明了人类病毒感染的确能够有效的激发RNAi抗病毒机制。
更为重要的是,人类神经前体细胞RNAi通路的存在为抗病毒药物的研发提供了新的靶标。研究人员进而对一种临床上广泛使用的“老药”依诺沙星(主要增强RNAi的效率)的抗病毒效果进行了评价,结果证实依诺沙星可以在神经前体细胞中有效阻断寨卡病毒感染,而且其抗病毒效果与其RNAi增强活性密切相关。此外,利用人类脑类器官模型发现,依诺沙星显示出非常高效的抗病毒作用,完全阻断了寨卡病毒感染所致的小头畸形表型。依诺沙星作为抗病毒药物潜力值得进一步的临床研究,同时以RNAi为靶标的抗病毒药物设计和发现将成为研究团队未来研究的重点。
总之,上述工作巧妙地利用了寨卡病毒这一具备独特组织嗜性的病毒,证实了RNAi这一古老的抗病毒信号通路的确可以作为人类抗病毒免疫体系的重要组成部分,为科学界这一长期争议提供了答案。同时,本文提出了以RNAi通路为靶标的抗病毒药物设计,为许多病毒性疾病的治疗提供了契机。
据悉,军事科学院军事医学研究院微生物流行病研究所博士研究生徐炎鹏、中科院武汉病毒所青年研究员邱洋、中科院动物所博士研究生张博雅和陈桂来为论文并列第一作者,军事科学院军事医学研究院秦成峰研究员、中科院武汉病毒所周溪研究员和中科院动物所胡宝洋研究员为论文并列通讯作者。
原文链接:
https://www.nature.com/articles/s41422-019-0152-9
参考文献
1. Wu, K. Y. et al. Vertical transmission of Zika virus targeting the radial glial cells affects cortex development of offspring mice. Cell Res. 26, 645–654 (2016).
2. Li, C. et al. Zika virus disrupts neural progenitor development and leads to microcephaly in mice. Cell Stem Cell 19, 672 (2016).
3. Yuan, L. et al. A single mutation in the prM protein of Zika virus contributes to fetal microcephaly. Science. 2017 Nov 17;358(6365):933-936.
4. Liu, Z. et al. The evolution of Zika virus from Asia to the Americas. Nat Rev Microbiol. 2019 Mar;17(3):131-139.
5. Li, Y., Lu, J., Han, Y., Fan, X. & Ding, S. W. RNA interference functions as an antiviral immunity mechanism in mammals. Science 342, 231–234 (2013).
6. Qiu, Y. et al. Human virus-derived small RNAs can confer antiviral immunity in mammals. Immunity 46, 992–1004 (2017).
扩展阅读:
VS好文推荐系列 | 黄病毒专题