通讯作者简介
陈明周, Ph.D., 武汉大学生命科学学院病毒学国家重点实验室教授,博士生导师,教育部“新世纪优秀人才支持计划”和湖北省“杰出青年基金”获得者,湖北省“楚天学者计划”特聘教授。1996年获华中农业大学土壤化学系学士学位,2002年获华中农业大学生命科学院微生物专业博士学位。2002-2005年于法国里昂第一大学从事麻疹病毒与宿主相互作用方面的博士后研究;2005-2009年于美国克里夫兰临床医院分子生物学系从事博士后研究。研究方向为负链RNA病毒转录、复制及其与宿主细胞的相互作用。在负链RNA病毒转录、复制及与宿主细胞的相互作用等方面中取得了很多原创性的贡献。在国际权威期刊Cell Host & Microbe、Autophagy、PLoS Pathogens、J Virol等刊物上发表多篇重要研究论文。
郑志明,M.D., Ph.D., 现任美国国立卫生研究院 (National Institutes of Health,NIH)高级研究员,美国微生物学会Fellow (American Academy of Microbiology Fellow)。
郑志明研究员于1994年加入NIH肿瘤病毒生物学实验室从事乳头瘤病毒RNA剪切机制研究。2000年成为NCI首席研究员,任肿瘤病毒RNA生物学研究室主任。2009任NCI高级 终身研究员,肿瘤病毒RNA生物学研究室主任。并于2009年获得NCI创新研究奖,2010年获NIH优秀研究员奖,2016 NIH亚太美国人组织科学成就奖,2016 NCI 优秀导师奖。
郑志明研究员目前的主要研究方向是卡波氏肉瘤病相关疱疹病毒(KSHV)和人乳头瘤病毒(HPV)感染的致癌机制、基因表达和转录调控、RNA-蛋白、RNA-RNA的相互作用及其机制研究。先后在国际著名期刊包括Lancet, PNAS, Cancer Cell, PLoS Pathogens, J Virol等发表论文200余篇。
摘要
应激颗粒(stress granules)和处理小体(processing bodies, PB)是两种RNA颗粒,是与宿主细胞抗病毒相关的重要组分。病毒感染诱导宿主细胞生成应激颗粒。然而,为达成有效感染和增殖,RNA病毒和DNA病毒必须能够抵御宿主天然免疫的不利环境,并利用各种策略阻止应激颗粒和处理小体的形成。本综述全面总结了RNA颗粒的特征以及不同病毒抑制宿主应激颗粒和PB形成的调控机制。
RNA granules are cytoplasmic, microscopically visible, non-membrane ribo-nucleoprotein structures and are important posttranscriptional regulators in gene expression by controlling RNA translation and stability. TIA/G3BP/PABP-specific stress granules (SG) and GW182/DCP-specific RNA processing bodies (PB) are two major distinguishable RNA granules in somatic cells and contain various ribosomal subunits, translation factors, scaffold proteins, RNA-binding proteins, RNA decay enzymes and helicases to exclude mRNAs from the cellular active translational pool. Although SG formation is inducible due to cellular stress, PB exist physiologically in every cell. Both RNA granules are important components of the host antiviral defense. Virus infection imposes stress on host cells and thus induces SG formation. However, both RNA and DNA viruses must confront the hostile environment of host innate immunity and apply various strategies to block the formation of SG and PB for their effective infection and multiplication. This review summarizes the current research development in the field and the mechanisms of how individual viruses suppress the formation of host SG and PB for virus production.
Figure展示
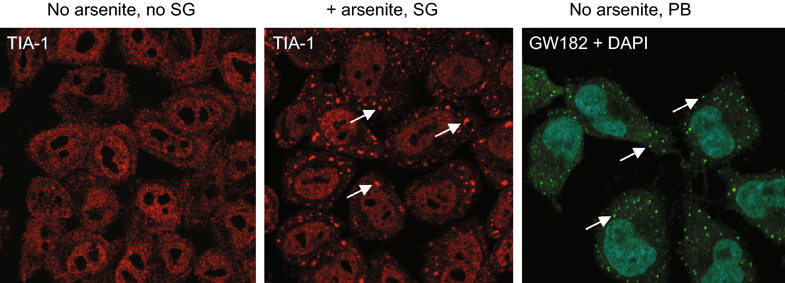
1 哺乳动物细胞中的RNA颗粒。
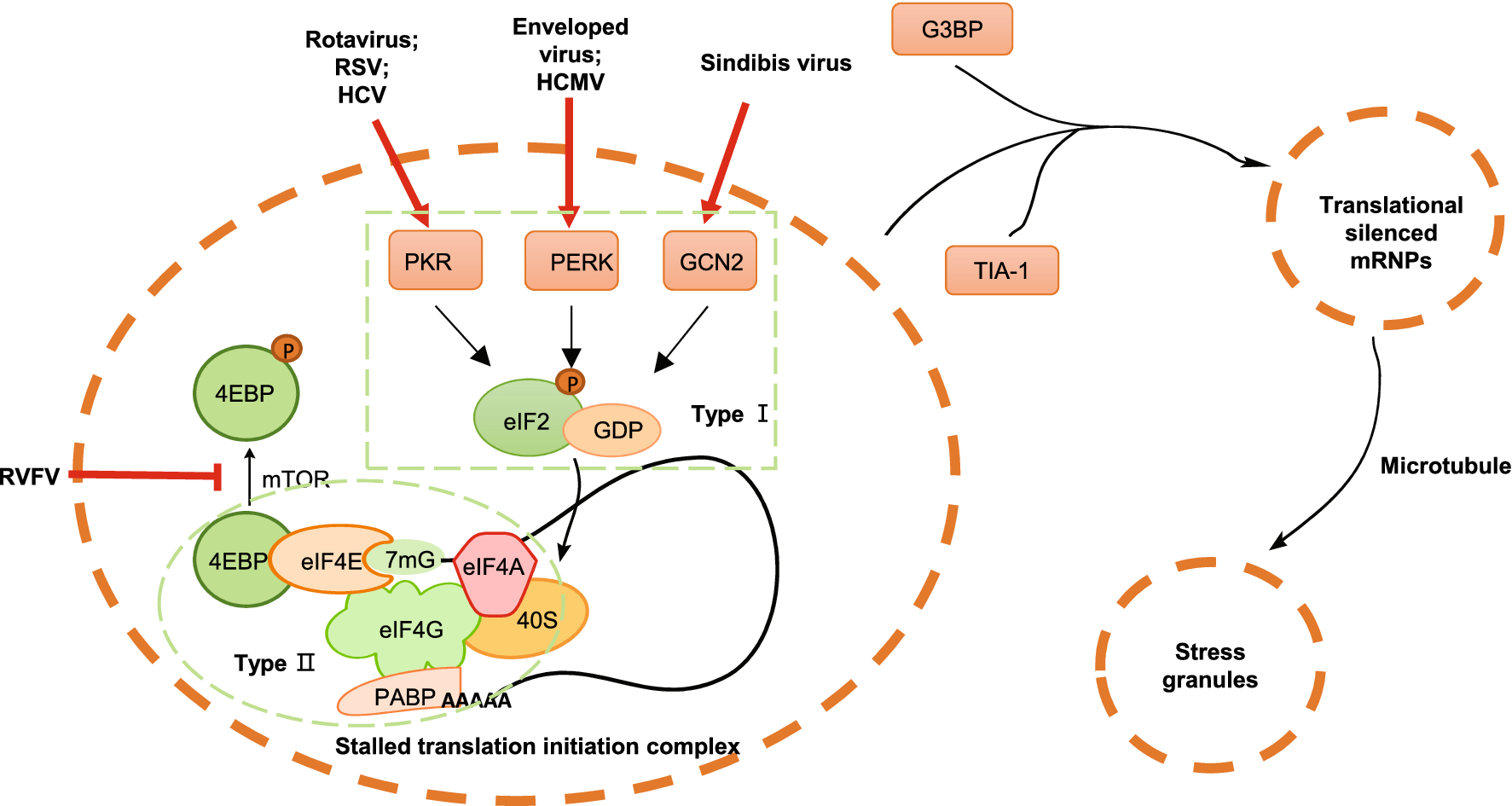
2 病毒诱导形成应激颗粒。
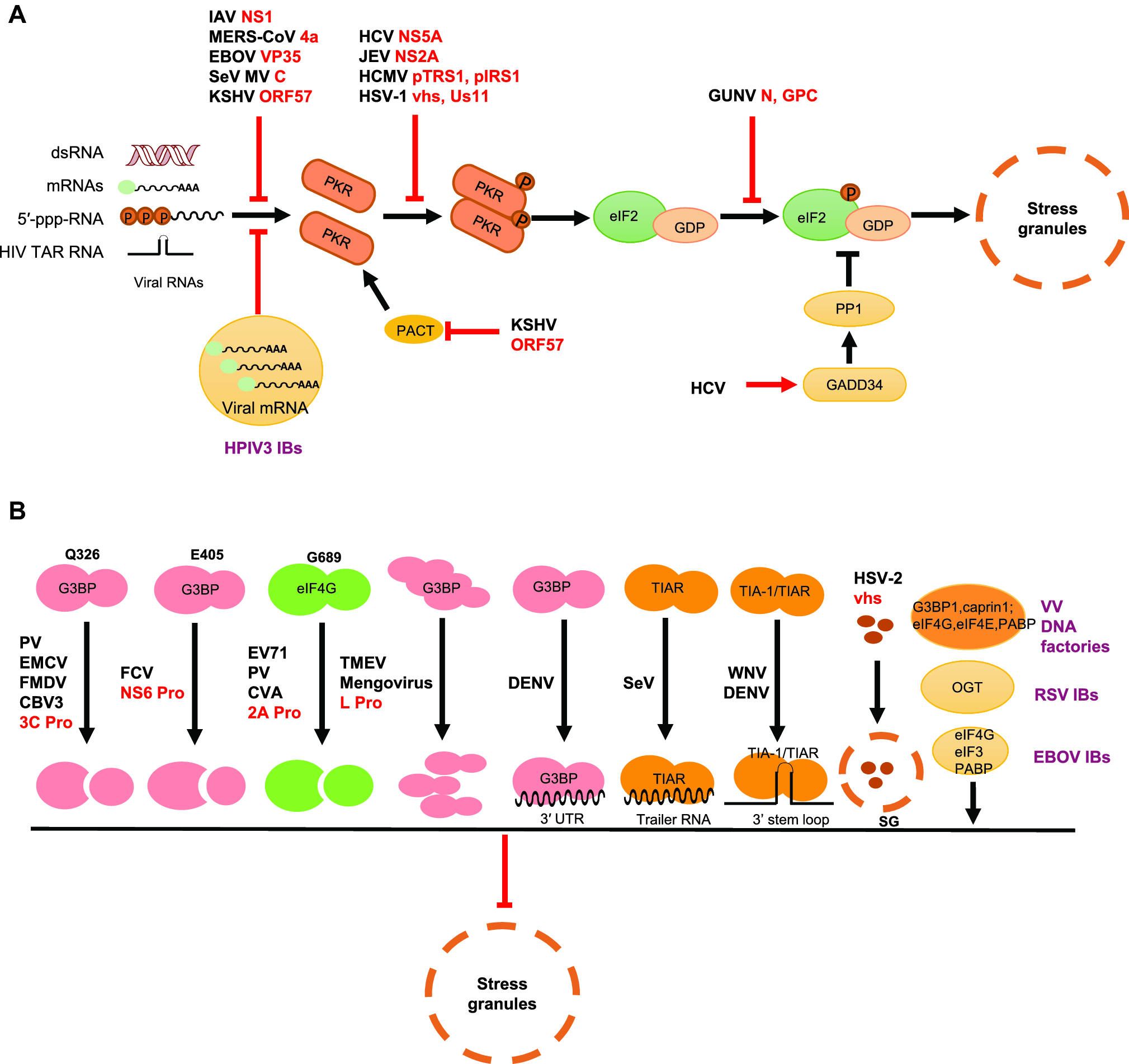
3 病毒干扰应激颗粒的生成。
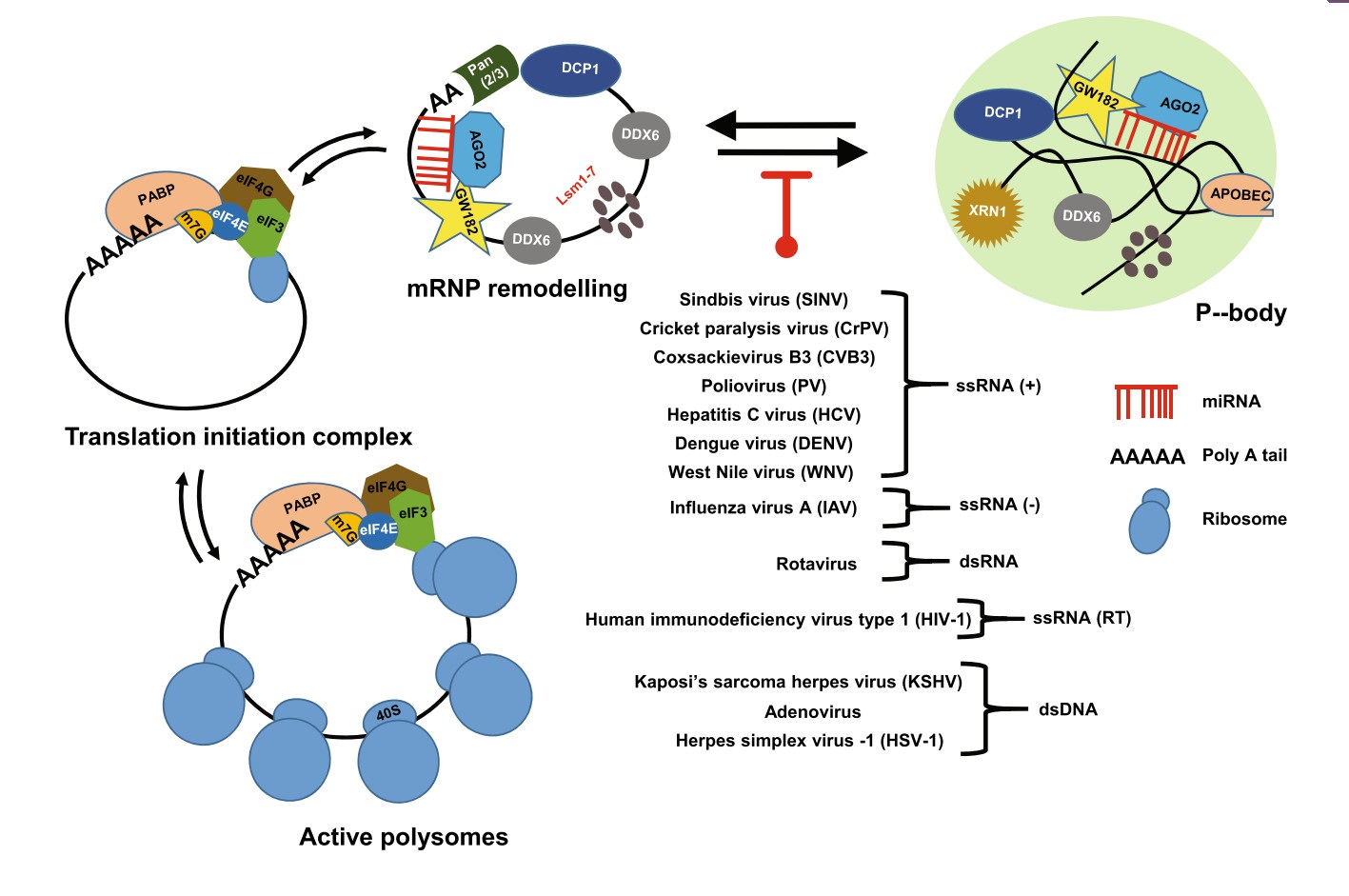
4 病毒干扰处理小体(PB)的组装。